活性化エネルギーについての授業動画はこちら
酵素 活性化エネルギー 高校生物 activation energy
https://youtu.be/zx-YkGmhYBc
https://youtu.be/zx-YkGmhYBc
l麗l酵素は,生体内での化学反応の触媒として働くタンパク質です。
酵素は触媒ですから、反応の前後で変化しません。
難しい原理は大学で学ぶとして、今は酵素に関する2種類のグラフを見ておきましょう。
発展:上のグラフは、様々な基質濃度を用意して、そこに一定量の酵素を加えて生成物の生成速度を測定したものである。各々の反応の初速度を測定する(徐々に酵素が変性するからである)。E+S⇄ESの反応は迅速に平衡に達する。ES→Pの反応(反応初期はPの量が数無いので、反応初速度を考える上では逆反応は無視できる)は、ESの濃度に依存する。反応開始後すぐにESの生成速度と分解速度が等しくなる=ESの濃度が一定になる(そのような状態を定常状態という)。すべての酵素がESになっているときに、ES→E+Pの反応速度が最大(Vmax)になる。
難しい話ですが、酵素は、活性化エネルギーを小さくすることで反応をすすみやすくしています。
このことはぼんやりとらえておけばOKです。
自然界には、「起きる可能性はあるが、非常に起きにくい」反応があります。生体内では、酵素を使うことでそのような反応が「起きやすい」状態をつくりだしているのです。
なんと、生体内で、11億年に一度しか起こらない反応を引き起こしている酵素もあるのです!
ただし、平衡状態にする速さが速くなるだけで、触媒は化学反応の平衡をずらすことはできないことを知っておきましょう。
例えば、A→Bのような化学反応は、やがて平衡に達するとAとBの濃度は一定となって変化が止まります。触媒はそうなるまで(平衡状態となるまで)の時間を短くできますが、平衡をずらし、最終的なAやBの濃度を変化させることはでいません。
酸化還元酵素,加水分解酵素など,様々なタイプの酵素があります。
たとえば,消化酵素の一つ,ペプシンは,タンパク質を分解する加水分解酵素です。
酵素は働く基質が決まっており,他の基質とは複合体を形成しないため,反応は起こりません。
酵素の働きを阻害する物質を阻害剤といい、競争的阻害剤と非競争的阻害剤があります。
競争的阻害剤は、酵素の基質と結合する部位(活性部位といいます)に結合し、酵素の反応を阻害します。
非競争的阻害剤は活性部位以外の部位に結合することで、反応を阻害します。
講習
□ テーマ : 酵素とは?
★酵素の特徴はめ~~~っちゃよく出る!「最適pH、最適温度、変性、失活、アロステリック部位、アロステリック酵素、補酵素、競争的阻害、非競争的阻害」を覚えるだけですぐ得点源になる!!
(1)酵素は生体触媒として働く!
酵素は基質と活性部位で結合して酵素―基質複合体を形成する。
その結果反応が起こり、基質は生成物に変化する。
酵素自身は反応の前後で変化しない。
触媒とは、「自らは変化せず、反応を促進する物質」。
補足
ふつう化学反応を開始させるにはエネルギーが必要。
このとき必要なエネルギーを活性化エネルギーという(物質を化学反応しうる活性化状態にさせるのに必要なエネルギーが活性化エネルギー)。
酵素も無機触媒も細胞の外でも働けることに注意せよ!
アクティブラーニング課題:どうして一般に温度が高くなると化学反応が起きやすくなるのか。説明せよ。
(化学反応はふつう高温により活性化エネルギーを得る。また、熱運動が激しくなるので分子同士の衝突する回数が増えると考えられている)
(2)酵素の特性は以下の2つが良く問われる!
アクティブラーニング課題:どうして一般に温度が高くなると化学反応が起きやすくなるのか。説明せよ。
(化学反応はふつう高温により活性化エネルギーを得る。また、熱運動が激しくなるので分子同士の衝突する回数が増えると考えられている)
(2)酵素の特性は以下の2つが良く問われる!
① 酵素の主成分はタンパク質である!
⇒それゆえ、最適温度、最適pHがある。
(無機触媒との違いとしてよく出題される!)
②酵素が特定の基質だけに作用する性質を基質特異性という。
高温やpHの大きな変動によってタンパク質は変性し、酵素は失活する。
酸化マンガン(Ⅳ)などの無機触媒は高温であればある程よく働く。
一般的な酵素の最適pHは7。ペプシンの最適pHは2!トリプシンの最適pHは8!
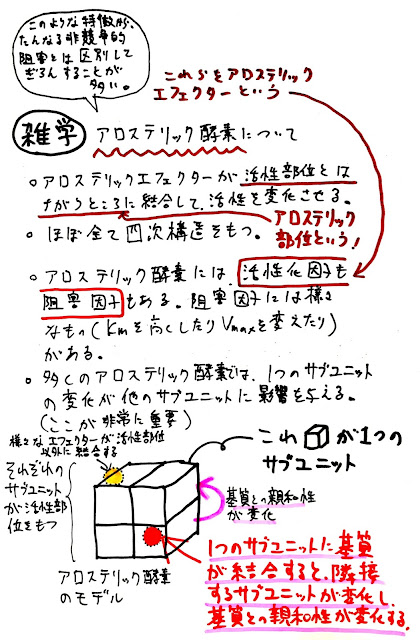
酵素には、活性部位の他にも、いろいろな機能を担っている部分がある。
活性部位を熱変性から守っていたり、活性部位と基質の結合・解離を抑制し、酵素反応の速さを調節したりする部位などがある。
□ テーマ2 : いろいろな種類の酵素を知っておこう!
(1)補酵素
酵素の主成分はタンパク質だが、タンパク質以外の低分子有機物を必要とする酵素もある!
酵素には、活性部位の他にも、いろいろな機能を担っている部分がある。
活性部位を熱変性から守っていたり、活性部位と基質の結合・解離を抑制し、酵素反応の速さを調節したりする部位などがある。
□ テーマ2 : いろいろな種類の酵素を知っておこう!
(1)補酵素
酵素の主成分はタンパク質だが、タンパク質以外の低分子有機物を必要とする酵素もある!
このような低分子有機物を補酵素という。
ふつう補酵素は熱に強い。
例えばNAD+(ニコチンアミドアデニンジヌクレオチドの略)は脱水素酵素に含まれる補酵素である。
補酵素はビタミンを含む場合が多い!
補足
似た言葉もあるので注意しよう。しかし、あまり定義が一般的でなく、研究者によっては区別しない人も多い。
補因子=酵素などのタンパク質の働きに必要なタンパク質以外の低分子。
補欠分子族=タンパク質に特に固く結合した補因子。
補酵素=補因子のうち、有機化合物であるもの。
(2)アロステリック酵素
酵素の作用が、基質とは異なる物質によって阻害または活性化されることがある。
このような酵素をアロステリック酵素といい、基質とは異なる物質が結合する場所をアロステリック部位という。
アロステリック酵素は、ふつう複雑な四次構造を持つので、そのグラフはS字になる。
補足
例えば,ホスホフルクトキナーゼという,哺乳類(ほにゅうるい)の解糖系の制御において,重要な役割を果たしている酵素がある。
この酵素はアロステリック酵素であり,解糖系の最終生成物であるATPにより制御される。
細胞内に十分量のATPが存在すると,酵素の反応速度が低下しATPの合成速度が下がる。
逆に,ATP濃度が下がると,反応速度が上がり,ATP濃度も上がる。
アクティブラーニング課題:アロステリック酵素の存在意義を応えよ。
(アロステリック酵素はフィードバック調節に使われ、過剰な生成物の蓄積や、無駄な基質の消費を抑えている。代謝の最終産物が、代謝経路の途中で働いている酵素に結合し、反応速度を下げることによる。)
酵素の活性部位以外のところに阻害剤が結合して、酵素の働きを抑えることを非競争的阻害という。
酵素の活性部位以外のところに阻害剤が結合して、酵素の働きを抑えることを非競争的阻害という。
本来の基質と競い合うようにして酵素の活性部位に阻害剤が結合し、結果的に酵素が本来の基質と結合できなくなることで酵素の働きが抑えられることを競争的阻害という。
競争的阻害を行う阻害剤には、また酵素の活性部位から離れられる可逆的なものと、二度と離れない不可逆的なものがある。
アクティブラーニング課題:非競争的阻害はなぜ酵素の働きを抑えるのだろうか。活性部位の立体構造が大切だということを思い出せ。
アクティブラーニング課題:非競争的阻害はなぜ酵素の働きを抑えるのだろうか。活性部位の立体構造が大切だということを思い出せ。
(一例を示す。酵素に阻害剤が結合すると、酵素をつくるタンパク質の形が変化する。その結果活性部位の立体構造も変わり、基質と反応できなくなる。
このように、タンパク質に、何か別の物質が結合すると、そのタンパク質の形が変わってしまうようなことはよくある。
オペロン説において、
リプレッサーにアロラクトースが結合すると、
リプレッサーの立体構造が変わり、
リプレッサーとDNAとの親和性が下がるのも似た例である。)
□ テーマ3 : 酵素には様々な種類がある!教科書や問題で目にするたびに確認しよう!
★にらめっこして覚える必要なし!問題に出てきたタイミングで復習すればOK!ただし、制限酵素とDNAリガーゼは例外!!めちゃめちゃよく出る!!
(1)加水分解酵素
アミラーゼ : デンプン → マルトース
アミラーゼはコウジカビなどの菌類も持つ。
マルターゼ : マルトース → グルコース
スクラーゼ: スクロース → グルコース+フルクトース
ラクターゼ : ラクトース → グルコース+ガラクトース
ペプシン : タンパク質 → ペプトン
ペプトンとは、タンパク質の不完全分解物である。
トリプシン : ペプトン → ポリペプチド(動物の細胞接着に関係するカドヘリンなどのタンパク質を壊す。DNA抽出実験の時に、タンパク質を分解する。)
キモトリプシン : ペプトン → ポリペプチド
ペプチダーゼ : ポリペプチド → アミノ酸
リパーゼ: 脂肪 → 脂肪酸+モノグリセリド
ペクチナーゼ : ペクチンを分解(カルスをつくる際に用いる)
セルラーゼ: セルロースを分解(カルスをつくる際に用いる)
ATPアーゼ : ATP → ADP+リン酸(ナトリウムポンプの本体は、ナトリウム-カリウム-ATPアーゼという酵素)
ウレアーゼ: 尿素 → 二酸化炭素+アンモニア
アルギナーゼ : アルギニン → オルニチン+尿素(オルニチン回路に関与)
トロンビン : フィブリノーゲン → フィブリン(血液凝固に関与)
制限酵素 : DNAを特定の塩基配列で切断!ヌクレオチド鎖の糖とリン酸の間を切断!(遺伝子組換えで用いる。細菌はウイルスのDNAを切断するために持っている。)
(2)酸化還元酵素
脱水素酵素(デヒドロゲナーゼ): 有機酸から水素を奪う(発酵・呼吸などに関与)
カタラーゼ : 過酸化水素 → 水+酸素(活性酸素が増えるのを防ぐ)
ニトロゲナーゼ : 窒素+水素→ アンモニア(窒素固定に関与)
アクティブラーニング課題:ニトロゲナーゼは酸素により活性が低下する。しかし窒素固定細菌のネンジュモは、シアノバクテリアの仲間であり、光合成も行う。
この問題にネンジュモは一応の対策を行うよう進化した。どのような対策が考えられるか。
(光合成ではなく窒素固定を専門に行う細胞を特別に用意し、その中でニトロゲナーゼを働かせている。)
ルシフェラーゼ : ルシフェリン+酸素 → 酸化ルシフェリン(ホタルの発光に関与)
硝酸還元酵素 : 硝酸 ― 酸素 → 亜硝酸(窒素同化の際植物の体内で行われる反応)
亜硝酸還元酵素 : 亜硝酸 ― 酸素 → アンモニア(窒素同化の際植物の体内で行われる反応)
(3)脱離酵素
脱炭酸酵素(デカルボキシラーゼ): 有機酸から二酸化炭素を発生
炭酸脱水酵素 : 炭酸 → 二酸化炭素+水(赤血球にある)
(4)転移酵素
アミノ基転移酵素: アミノ酸が持つアミノ基を有機酸に移す(窒素同化に関与)
クレアチンキナーゼ : クレアチンリン酸のリン酸をADPに移す(筋収縮に関与)
(5)その他の酵素
DNAポリメラーゼ: DNAを鋳型にDNAを複製(DNA合成期に働く。好熱細菌のDNAポリメラーゼは熱に強く、PCRで使われる。)
RNAポリメラーゼ: DNAを鋳型にRNAを合成(転写に働く。真核生物のRNAポリメラーゼは単独では働かない。基本転写因子が必要。また、クロマチン繊維が緩むことも必要。このようにRNAポリメラーゼが働く際の調節機構が解明されつつある。)
DNAリガーゼ : DNAの切断端同士を結合(遺伝子組換えで用いる)
アミノアシルtRNA合成酵素 : アミノ酸とtRNAを合成
逆転写酵素 : RNAを鋳型にDNAを合成(この現象を逆転写という)
グルタミン合成酵素 : グルタミン酸とアンモニアからグルタミンを合成(窒素同化に関与、名前通りの働き)
グルタミン酸合成酵素 : グルタミンとケトグルタル酸からグルタミン酸を合成(窒素同化に関与、名前通りの働き)
ルシフェラーゼ : ルシフェリン+酸素 → 酸化ルシフェリン(ホタルの発光に関与)
硝酸還元酵素 : 硝酸 ― 酸素 → 亜硝酸(窒素同化の際植物の体内で行われる反応)
亜硝酸還元酵素 : 亜硝酸 ― 酸素 → アンモニア(窒素同化の際植物の体内で行われる反応)
(3)脱離酵素
脱炭酸酵素(デカルボキシラーゼ): 有機酸から二酸化炭素を発生
炭酸脱水酵素 : 炭酸 → 二酸化炭素+水(赤血球にある)
(4)転移酵素
アミノ基転移酵素: アミノ酸が持つアミノ基を有機酸に移す(窒素同化に関与)
クレアチンキナーゼ : クレアチンリン酸のリン酸をADPに移す(筋収縮に関与)
(5)その他の酵素
DNAポリメラーゼ: DNAを鋳型にDNAを複製(DNA合成期に働く。好熱細菌のDNAポリメラーゼは熱に強く、PCRで使われる。)
RNAポリメラーゼ: DNAを鋳型にRNAを合成(転写に働く。真核生物のRNAポリメラーゼは単独では働かない。基本転写因子が必要。また、クロマチン繊維が緩むことも必要。このようにRNAポリメラーゼが働く際の調節機構が解明されつつある。)
DNAリガーゼ : DNAの切断端同士を結合(遺伝子組換えで用いる)
アミノアシルtRNA合成酵素 : アミノ酸とtRNAを合成
逆転写酵素 : RNAを鋳型にDNAを合成(この現象を逆転写という)
グルタミン合成酵素 : グルタミン酸とアンモニアからグルタミンを合成(窒素同化に関与、名前通りの働き)
グルタミン酸合成酵素 : グルタミンとケトグルタル酸からグルタミン酸を合成(窒素同化に関与、名前通りの働き)